by Apep Ependi, S. Si
Salam,
Tulisan ini mengenai Tips dan Triks Menguasai Materi Larutan Elektrolit dan Non Elektrolit.
Materi Larutan Elektrolit dan Non Elektrolit merupakan Materi Kimia yang diberikan kepada siswa di kelas X. Materi Larutan Elektrolit dan Non Elektrolit merupakan materi pendahuluan bagi siswa untuk mempelajari Materi Elektrokimia di kelas XII nanti. Sehingga, diharapkan siswa mampu menguasai materi Larutan Elektrolit dan Non Elektrolit di kelas X ini.
Nah, untuk menguasai dengan cepat Materi Larutan Elektrolit dan Non Elektrolit ini, silahkan perhatikan penjelasan di bawah ini:
Dari istilah-istilah di atas, timbulah pertanyaan-pertanyaan di bawah ini:
Salam,
Tulisan ini mengenai Tips dan Triks Menguasai Materi Larutan Elektrolit dan Non Elektrolit.
Materi Larutan Elektrolit dan Non Elektrolit merupakan Materi Kimia yang diberikan kepada siswa di kelas X. Materi Larutan Elektrolit dan Non Elektrolit merupakan materi pendahuluan bagi siswa untuk mempelajari Materi Elektrokimia di kelas XII nanti. Sehingga, diharapkan siswa mampu menguasai materi Larutan Elektrolit dan Non Elektrolit di kelas X ini.
Nah, untuk menguasai dengan cepat Materi Larutan Elektrolit dan Non Elektrolit ini, silahkan perhatikan penjelasan di bawah ini:
Pesan: Selalu, munculkan pertanyaan-pertanyaan ketika menemukan suatu istilah baru, sehingga istilah baru tersebut dapat kalian pahami definisinya.
Dari Materi Larutan Elektrolit dan Non Elektrolit di atas, istilah baru yang muncul adalah:
- Larutan adalah suatu pencampuran 2 zat, yaitu zat terlarut (solute) dengan pelarut (solvent).
- Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik
- Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik
Pertanyaan ke-1: Mengapa
larutan elektrolit dapat menghantarkan arus listrik, sedangkan larutan non elektrolit tidak dapat menghantarkan arus listrik?
Jawab: Karena larutan elektrolit mengandung ion-ion yang bebas, sedangkan larutan non elektrolit tidak mengandung ion-ion bebas.
Pertanyaan ke-2: Dari mana
asal ion-ion bebas tersebut?
Jawab: Ion-ion bebas yang dikandung oleh larutan elektrolit berasal dari penguraian zat terlarut oleh molekul air atau dengan kata lain, zat terlarut mengalami reaksi ionisasi.
Pertanyaan ke-3: Apakah semua zat terlarut akan mengalami reaksi
ionisasi?
Jawab: Tidak, hanya senyawa:
a. Garam
ciri utama: terbentuk oleh atom logam dengan nonlogam.
contoh: NaCl, KBr, AgSO4, MgF2, dll
b. Asam
ciri utama: senyawaannya mengandung atom H dan terletak di depan
contoh: HCl, HBr, HI, H2SO4, HNO3, H2S, dll
kecuali: H2O (air) dan CH3COOH (atom H, terletak di belakang)
c. Basa
ciri utama: senyawaanya mengandung OH (ion hidroksida) terletak di belakang
contoh: NaOH, Ca(OH)2, Al(OH)3, KOH, dll
kecuali: senyawaan alkohol (C2H5OH)
Sehingga dari jawaban ini, kalian dapat membedakan mana larutan elektrolit dan bukan. Nah, setelah kalian dapat membedakan larutan elektrolit dengan non elektrolit, perlu diketahui lagi bahwa larutan elektrolit itu terbagi 2 jenis, yaitu:
a. elektrolit kuat
b. elektrolit lemah
Pertanyaan ke-4: Mengapa larutan
elektrolit terbagi dua?
Jawab: Karena perbedaan dalam proses ionisasi atau derajat disosiasinya
Pertanyaan ke-5: Apa yang dimaksud dengan
derajat disosiasi?
Jawab: Derajat disosiasi adalah angka yang menunjukkan besaran jumlah mol zat yang terion dibagi dengan mol mula-mula, dengan rumus:
Elektrolit kuat memiliki nilai α = 1, sedangkan elektrolit lemah memiliki nilai 0 < α < 1.
Pertanyaan ke-6: Bagaimana cara
membedakan elektrolit kuat dengan elektrolit lemah dalam soal?
Jawab: Mudah, Ingat! Senyawa yang termasuk elektrolit adalah Garam, Asam, dan Basa.
a. Garam, umumnya elektrolit kuat, kecuali garam yang sukar larut
b. Asam
asam kuat merupakan elektrolit kuat
asam lemah merupakan elektrolit lemah
c. Basa
basa kuat merupakan elektrolit kuat
basa lemah merupakan elektrolit lemah
Nah, sekarang. Untuk mengetahui mana Asam Kuat, Asam Lemah, Basa Kuat, dan Basa Lemah cukup hafalkan yang Kuat saja maka yang Lemah akan terhafalkan juga.
Pertanyaan ke-7: Lalu, bagaimana cara
membedakan asam kuat dengan asam lemah dan basa kuat dengan basa lemah?
Jawab: Baca lagi jawaban pertanyaa sebelumnya. Cukup hafalkan saja yang kuat
A. Asam Kuat, ada 4 (diurutkan berdasarkan kekuatannya):
1. asam sulfat (H2SO4)
2. asam nitrat (HNO3)
3. asam-asam halida, kecuali HF (HCl, HBr, dan HI)
4. asam-asam oksihalogen, hanya:
a. asam halat (HXO3) HClO3, HBrO3, dan HIO3
b. asam perhalat (HXO4) HClO4, HBrO4, dan HIO4
B. Basa Kuat, ada 2:
1. basa dari kationnya golongan IA, kecuali H dengan Fr (LiOH, NaOH, KOH, RbOH, dan CsOH)
2. basa dari kationnya golongan IIA, kecuali Be dengan Ra (Mg(OH)2, Ca(OH)2, Sr(OH)2, dan Ba(OH)2)
Nah, selain senyawa di atas maka termasuk asam dan basa lemah. Bagaimana sekarang sudah dapat membedakan mana larutan elektrolit kuat dengan larutan elektrolit lemah.
Pertanyaan ke-8: Penjelasan di
atas itu semuanyakan dalam teori, lalu bagaimana praktiknya?
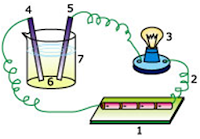
Jawab: Okeh, Praktik yang dilakukan untuk membedakan Larutan Elektrolit Kuat, Elektrolit Lemah, dengan Non Elektrolit, dilakukan dengan menggunakan rangkaian alat di bawah ini:
Kesimpulan yang didapat:
Dari tabel di atas, untuk membedakan larutan elektrolit dengan dengan non elektrolit cukup dilihat dari gelembung gas, sedangkan untuk membedakan larutan elektrolit kuat dengan elektrolit lemah cukup dilihat nyala lampu.
Bagaimana, penjelasan
di atas. Dapat dipahamikan!. Jika masih memiliki pertanyaan atau ingin melihat
contoh latihan soalnya, silahkan miliki bukunya “Chemistry is Easy X” di toko-toko
buku terdekat atau
Hubungi (via sms): 08176515821 untuk memesan.
Wa’salam.

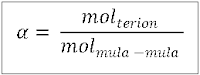




Wah detail banget nih penjelasannya...
BalasHapusthanks for sharing