by Apep Ependi, S. Si
Silahkan, miliki bukunya "Chemistry is Easy X, hubungi via sms: 08176515821
Wa’salam.
Salam,
Okeh ..., terima kasih
masih setia baca tulisan POJOKIMIA. Masih mengenai Tips & Trik, kali ini tentang “Cara Cepat Menguasai Reaksi Reduksi-Oksidasi”.
Materi Reaksi
Reduksi-Oksidasi merupakan materi Kimia yang diberikan kepada siswa
SMA/MA kelas X di semester 2. Materi ini diberikan setelah siswa menguasai
materi Larutan Elektrolit dan Non Elektrolit (silahkan, kunjungi Tips
dan Triksnya).
Selalu inget pesan ini “Tumbuhkan
rasa ingin tahu dengan membuat pertanyaan-pertanyaan”.
Pertanyaan ke-1:
Apa sih yang dimaksud dengan Reaksi
Reduksi dan Oksidasi?
|
Jawab:
Reaksi Reduksi dan
Oksidasi mempunyai 3 jenis definisi.
|
Tanya:
Apa
aja tuh?
|
Jawab:
Nih! Yang ke:
1. berdasarkan
atom oksigen (O)
Reduksi adalah spesi yang kehilangan
atom O-nya
Oksidasi adalah spesi yang bertambah
atom O-nya
reaksi:
Fe2O3 +
C à Fe + CO2
jadi:
Fe2O3 à Fe
(Fe dari Fe2O3 mengalami
reduksi, awalnya punya 2 atom O dan akhirnya tidak ada atom O)
C
à CO2
(C mengalami oksidasi, awalnya tidak
punya O dan akhirnya punya 2 atom O)
2. berdasarkan
elektron
Reduksi adalah spesi yang menerima
elektron (elektron ada di bagian kiri)
Oksidasi adalah spesi yang melepas
elektron (elektron ada di bagian kanan)
reaksi:
Fe2+ + 2e- à Fe
(Fe2+ mengalami reduksi,
elektron ada di sebelah kiri)
Cu à Cu2+ + 2e-
(Cu mengalami oksidasi, elektron ada di
sebelah kanan)
3. berdasarkan
biloks (bilangan oksidasi)
Reduksi adalah spesi yang mengalami
penurunan biloks
Oksidasi adalah spesi yang mengalami
penambahan biloks
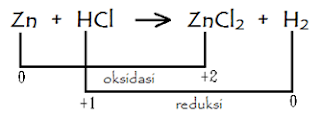
reaksi:
jadi:
Zn mengalami oksidasi, biloks naik
dari 0 ke +2
Atom H dari HCl, biloks turun dari +1
ke 0
|
Bagaimana,
sudah paham? Kalo belum, baca lagi penjelasan di atas. Tapi kalo sudah,
silahkan lanjut ke pertanyaan ke-2
|
Pertanyaan ke-2:
Lalu, ada istilah reduktor dan oksidator, apa lagi
itu?
|
Jawab:
ü Reduktor
atau pereduksi adalah senyawa yang menyebabkan senyawa lain
mengalami reduksi (dia sendiri mengalami oksidasi)
ü Oksidator
atau pengoksidasi adalah senyawa yang menyebabkan senyawa lain
mengalami oksidasi (dia sendiri mengalami reduksi)
contoh:
jadi:
Zn
sebagai pereduksi/reduktor
HCl
sebagai pengoksidasi/oksidator
|
Bagaimana,
sudah paham? Kalo belum, baca lagi penjelasan di atas. Tapi kalo sudah,
silahkan lanjut ke pertanyaan ke-3
|
Pertanyaan ke-3:
Ada tidak yah? Satu atom mengalami dua peristiwa
sekaligus (mengalami reduksi dan juga oksidasi)?
|
Jawab:
Ada, itu yang dikenal dengan
reaksi autoredoks atau disproporsionasi
|
Bisa diperjelas!
|
Jawab:
Reaksi
autoredoks atau disproporsionasi
adalah reaksi redoks di mana satu unsur/atom mengalami reaksi reduksi
dan oksidasi sekaligus
Contoh:
Jadi:
Cl
mengalami reduksi dan oksidasi
Tapi,
reaksi autoredoks atau disproporsionasi bukan hanya seperti reaksi di atas.
Dapat juga seperti reaksi di bawah ini:
Kalau reaksi pertama 1 menjadi 2,
sedangkan pada reaksi kedua 2 menjadi 1.
|
Bagaimana,
sudah paham? Kalo belum, baca lagi penjelasan di atas. Tapi kalo sudah,
silahkan lanjut ke pertanyaan ke-4
|
Pertanyaan ke-4:
Apa sih penerapan reaksi reduksi-oksidasi (redoks)
ini dalam kehidupan sehari-hari?
|
Jawab:
1.
Pengolahan
limbah (dengan lumpur aktif)
Prinsipnya dengan mengoksidasi bahan-bahan limbah
(organik maupun non organik) dengan bantuan mikrookganisme (Escherichia coli,
Enterobacter, Sphaerotilus natans, Beggatoa, Achromobacter, Fla-vobacterium,
dan Pseudomonas) agar lebih mudah diolah lebih lanjut.
2.
Sel Volta
Merupakan sumber energi listrik siap pakai (seperti:
baterai dan accumulator)
|
Silahkan, miliki bukunya "Chemistry is Easy X, hubungi via sms: 08176515821
Wa’salam.







nice share gan.
BalasHapuskalo berkenan follow back blog ane gan :) hishoot.blogspot.com
Gan, ane ijin copy paste ke blog ane ya gan. Santai aja gan, sumbernya pasti saya cantumkan deh, terima kasih ya gan :D
BalasHapus