by Apep Ependi, S.Si
Salam,
Postingan ini mengenai Materi atau Bahan ajar Kimia tentang "sifat koligatif larutan". Postingan Materi atau Bahan ajar sifat koligatif larutan ini merupakan postingan POJOKIMIA yang kedua.
Pada Materi atau Bahan ajar sifat koligatif larutan ini, siswa diharapkan dapat: mendeskripsikan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku dan tekanan osmotik, termasuk sifat koligatif larutan, serta membandingkan sifat koligatif larutan elektrolit dengan sifat koligatif larutan nonelektrolit pada konsentrasi yang sama
Konsentrasi larutan menyatakan banyaknya zat terlarut dalam suatu larutan, dapat dinyatakan dengan: molaritas (M), molalitas (m), dan fraksi mol (Xa).
Sifat koligatif larutan, terdiri dari: penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
Antara sifat koligatif larutan elektrolit dengan larutan nonelektrolit dipengaruhi oleh faktor van Hoff. Dikarenakan, bahwa larutan elektrolit akan terbagi 2 jenis, yaitu larutan elektrolit kuat (terurai 100% membentuk ion-ionnya) dan larutan elektrolit lemah (terurai sebagian bergantung derajat ionisasi), sedangkan larutan nonelektrolit karena tidak terurai maka faktor van Hoff sama dengan 1.
Silahkan lihat tampilan-tampilannya di bawah ini:
Kalau masih penasaran, silahkan unduh saja filenya pada link: Sifat Koligatif Larutan ini.
File dalam bentuk swf yang dapat dijalankan dengan sofware flash player, jika belum punya aplikasinya, silahkan ke halaman Bantuan ini. Jika link unduhan RUSAK, mohon tuliskan informasinya di komentar.
File yang telah didownload/diunduh, gunakanlah dengan BIJAK !!!
Dan, Ingat, pada Motto ini:
Silahkan, berikan komentar/saran (BEBAS, tapi tidak SARA).
Akhir kata semoga, apa yang saya berikan dapat kalian ambil manfaatnya.
Wa'salam
 |
| diagram PT |
Postingan ini mengenai Materi atau Bahan ajar Kimia tentang "sifat koligatif larutan". Postingan Materi atau Bahan ajar sifat koligatif larutan ini merupakan postingan POJOKIMIA yang kedua.
Pada Materi atau Bahan ajar sifat koligatif larutan ini, siswa diharapkan dapat: mendeskripsikan penurunan tekanan uap, kenaikan titik didih, penurunan titik beku dan tekanan osmotik, termasuk sifat koligatif larutan, serta membandingkan sifat koligatif larutan elektrolit dengan sifat koligatif larutan nonelektrolit pada konsentrasi yang sama
Konsentrasi larutan menyatakan banyaknya zat terlarut dalam suatu larutan, dapat dinyatakan dengan: molaritas (M), molalitas (m), dan fraksi mol (Xa).
Sifat koligatif larutan, terdiri dari: penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
Antara sifat koligatif larutan elektrolit dengan larutan nonelektrolit dipengaruhi oleh faktor van Hoff. Dikarenakan, bahwa larutan elektrolit akan terbagi 2 jenis, yaitu larutan elektrolit kuat (terurai 100% membentuk ion-ionnya) dan larutan elektrolit lemah (terurai sebagian bergantung derajat ionisasi), sedangkan larutan nonelektrolit karena tidak terurai maka faktor van Hoff sama dengan 1.
Silahkan lihat tampilan-tampilannya di bawah ini:
 |
| tujuan sifat koligatif larutan |
 |
| konsentrasi larutan |
 |
| kenaikan titik didih dan penurunan titik beku |
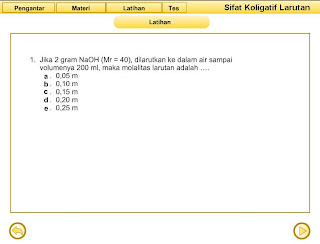 |
| latihan sifat koligatif larutan |
File dalam bentuk swf yang dapat dijalankan dengan sofware flash player, jika belum punya aplikasinya, silahkan ke halaman Bantuan ini. Jika link unduhan RUSAK, mohon tuliskan informasinya di komentar.
File yang telah didownload/diunduh, gunakanlah dengan BIJAK !!!
Dan, Ingat, pada Motto ini:
CHEMISTRY IS EASY IF YOU STUDY
Silahkan, berikan komentar/saran (BEBAS, tapi tidak SARA).
Akhir kata semoga, apa yang saya berikan dapat kalian ambil manfaatnya.
Wa'salam




bang.. linknya udah mati.. tolong di update.. terima kasih..
BalasHapusgak bisa dibuka filenya
BalasHapuskok gak bisa dibuka ya filenya
BalasHapusmohon maaf, filenya dalam bentuk swf. silahkan, download sofware pendukungnya
Hapus