by Apep Ependi, S.Si
Salam,
Postingan kali ini mengenai materi atau bahan ajar kimia kelas sebelas (XI) tentang "laju reaksi".
Postingan ini merupakan postingan POJOKIMIA yang ketiga mengenai laju reaksi.
Pada materi atau bahan ajar laju reaksi ini, siswa menjelaskan satuan konsentrasi, definisi laju reaksi, hubungan koefisien reaksi dengan laju reaksi, faktor-faktor yang memengaruhi laju reaksi, menjelaskan teori tumbukan, persamaan laju reaksi, orde reaksi, dan peranan katalis dalam makhluk hidup dan industri.
Satuan konsentrasi banyak sekali, tetapi yang umum digunakan adalah molaritas (M), persen (%), dan normalitas (N). Molaritas adalah banyaknya mol zat terlarut dalam liter larutan. Persen adalah banyaknya zat terlarut pervolume atau perberat campuran. Sedangkan, Normalitas adalah banyaknya mol ekivalen zat terlarut dalam liter larutan.
Laju reaksi didefinisikan sebagai perubahan konsentrasi zat-zat persatuan waktu. Reaktan selalu berkurang sedangkan produk selalu bertambah konsentrasinya. Cepat atau lambatnya reaksi bergantung pada koefisien reaksi, dimana zat yang memiliki koefisien 2, laju reaksinya akan lebih cepat 2 kali dibandingkan zat yang memiliki koefisien 1. Laju reaksi dipengaruhi oleh: Konsentrasi, Luas permukaan sentuh, Suhu, dan Katalis.
Faktor-faktor yang memengaruhi laju reaksi dijelaskan dengan teori tumbukan. Menurut teori tumbukan suatu zat dikatakan bereaksi jika antar zat-zat pereaksi saling bertumbukan dan membentuk zat baru. Konsentrasi memengaruhi laju reaksi karena semakin besar konsentrasi maka zat-zat yang bereaksi semakin banyak. Luas permukaan sentuh memengaruhi laju reaksi disebabkan semakin banyak permukaan sentuh maka kemungkinan terjadinya tumbukan semakin besar. Suhu memengaruhi laju reaksi dikarenakan akan meningkatkan energi kinetik dari zat-zat yang bereaksi. Sedangkan, katalis memengaruhi laju reaksi dikarenakan menurunkan energi aktivasi.
Silahkan lihat tampilan-tampilan di bawah ini:
Kalau masih belum cukup dengan tampilan di atas, silahkan unduh saja filenya pada link: Laju Reaksi ini.
File ini dalam bentuk file ppsx dapat langsung dijalankan.
Kalo sudah didownload/diunduh, gunakanlah dengan BIJAK !!!
Ingat, pada Motto ini:
Silahkan, berikan komentar/saran (BEBAS, tapi tidak SARA).
Akhir kata semoga, apa yang saya berikan dapat kalian ambil manfaatnya.
Wa'salam
 |
| ledakan bom |
Postingan kali ini mengenai materi atau bahan ajar kimia kelas sebelas (XI) tentang "laju reaksi".
Postingan ini merupakan postingan POJOKIMIA yang ketiga mengenai laju reaksi.
Pada materi atau bahan ajar laju reaksi ini, siswa menjelaskan satuan konsentrasi, definisi laju reaksi, hubungan koefisien reaksi dengan laju reaksi, faktor-faktor yang memengaruhi laju reaksi, menjelaskan teori tumbukan, persamaan laju reaksi, orde reaksi, dan peranan katalis dalam makhluk hidup dan industri.
Satuan konsentrasi banyak sekali, tetapi yang umum digunakan adalah molaritas (M), persen (%), dan normalitas (N). Molaritas adalah banyaknya mol zat terlarut dalam liter larutan. Persen adalah banyaknya zat terlarut pervolume atau perberat campuran. Sedangkan, Normalitas adalah banyaknya mol ekivalen zat terlarut dalam liter larutan.
Laju reaksi didefinisikan sebagai perubahan konsentrasi zat-zat persatuan waktu. Reaktan selalu berkurang sedangkan produk selalu bertambah konsentrasinya. Cepat atau lambatnya reaksi bergantung pada koefisien reaksi, dimana zat yang memiliki koefisien 2, laju reaksinya akan lebih cepat 2 kali dibandingkan zat yang memiliki koefisien 1. Laju reaksi dipengaruhi oleh: Konsentrasi, Luas permukaan sentuh, Suhu, dan Katalis.
Faktor-faktor yang memengaruhi laju reaksi dijelaskan dengan teori tumbukan. Menurut teori tumbukan suatu zat dikatakan bereaksi jika antar zat-zat pereaksi saling bertumbukan dan membentuk zat baru. Konsentrasi memengaruhi laju reaksi karena semakin besar konsentrasi maka zat-zat yang bereaksi semakin banyak. Luas permukaan sentuh memengaruhi laju reaksi disebabkan semakin banyak permukaan sentuh maka kemungkinan terjadinya tumbukan semakin besar. Suhu memengaruhi laju reaksi dikarenakan akan meningkatkan energi kinetik dari zat-zat yang bereaksi. Sedangkan, katalis memengaruhi laju reaksi dikarenakan menurunkan energi aktivasi.
Silahkan lihat tampilan-tampilan di bawah ini:
 |
| standar kompetensi laju reaksi |
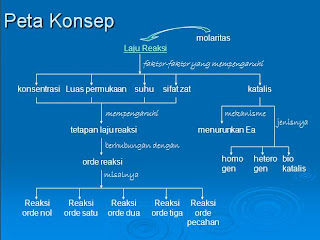 |
| peta konsep laju reaksi |
 |
| penyelesaian kasus pada laju reaksi |
 |
| pengaruh konsentrasi pada laju reaksi |
File ini dalam bentuk file ppsx dapat langsung dijalankan.
Kalo sudah didownload/diunduh, gunakanlah dengan BIJAK !!!
Ingat, pada Motto ini:
CHEMISTRY IS EASY IF YOU STUDY
Silahkan, berikan komentar/saran (BEBAS, tapi tidak SARA).
Akhir kata semoga, apa yang saya berikan dapat kalian ambil manfaatnya.
Wa'salam




0 komentar:
Posting Komentar